یکی از بزرگترین امیدواری ها در پی مطالعات ژنتیکی آن است که فهم ودرک ژنوم انسان، ما را قادر به علاج یا حتی پیشگیری از بیماری های ژنتیکی خواهد ساخت. حال که نقشه ای از تمامی ژن های انسان به دست آمده، هدف بعدی محققان، درک بهتر عملکرد مجزای هر کدام از این ژن ها و اینکه چگونه نقصی در عملکرد آنها باعث بیماری می شود، خواهد بود. درک این موضوع به دانشمندان این جازه را خواهد داد تا ژن های معیوب یا غایب را با انواع سالم، جایگزین یا تکمیل کننده و در واقع با این کار به جای درمان پیامدها، به شکل پایه ای با مشکل برخورد می کنند. این اقدام را اصطلاحاً ژن درمانی می نامند.
کاربردها
اگرچه بسیاری از محققان از مدت ها پیش آزمایشات بر روی ژن درمانی را آغاز کرده اند، امّا این عرصه هنوز در مراحل ابتدایی خود به سر می برد. اکثر موارد ژن درمانی در حال حاضر در کار آزمایی های بالینی به دقت کنترل شده ای صورت می گیرند. با این وجود، تقریباً همه بیمازی رایجی هم از نظر ژنتیکی و هم از جنبه متداول تر آن، مورد مطالعه قرار می دهند. برخی از عمده ترین کاربردهای احتمالی ژن درمانی عبارتند از:
جایگزینی یک ژن معیوب یا ناقص
جایگزین کردن یک ژن معیوب یا ناقص، روشی است که بیماری ها ناشی از نقص یک ژن منفرد را در بر می گیرد: مثلاً، فیبروزکیستی، هموفیلی، بیماری هانتینگتون، و بیماری تی- ساکس همگی با جهش هایی در یک یا هر دو نسخه از جفت ژن خاص در ارتباط هستند.
تحقیقات بر روی سلول بنیادی
بحث در مورد سلول های بنیادی و توانایی آنها در علاج بیماری ها از جمله موضوعات مورد توجه و رو به رسد است. امّا به راستی منظور از سلول های بنیادی چیست و چرا اینقدر مهم هستند؟
منظور از سلول های بنیادی چیست؟
سلول های بنیادی، سلول های ابتدایی تمایز نیافته ای هستند که توانایی تقسیم خود به خود و تولید هر تعداد از سلول های تمایز یافته و اختصاصی تر را دارند. بیشترین اهمیت آنها مربوط به دوران جنینی است که رشد و تکامل یک سلول منفرد را تا تبدیل آن به یک انسان کامل و بالغ هدایت و اصطلاحاً مهندسی می کند. سلول های بنیادی جنین انسان دارای توانایی تقسیم و تمایز یافتن به هر نوع سلول موجود در بدن انسان می باشند. پس از تولد، سلول های بنیادی همچنان در بدن شما باقی می مانند (سلول های بنیادی بالغ) امّا، وظیفه آنها محدود به تولید سلول های موردنیاز بافت ها و اعضاء خاص که در آنجا حضور دارند می باشد، مثل پوست یا استخوان.
استفاده درمانی از سلول های بنیادی
سلول های بنیادی توجه دانشمندان و عموم مردم را به خود معطوف ساخته اند که علت آن توانایی آنها در جایگزینی سلول های معیوب یا بیمار است. فعلاً، بیشترین استفاده از سلول های بنیادی در پیوند مغز استخوان برای درمان افراد مثلاً به بیماری هایی مثل لوسمی، لنفم، کم خونی آپلاستیک و برخی از اختلالات ایمنی ارثی است. مغز استخوان، و حتی جریان خون حاوی سلول های بنیادی خون هستند که قادر به تولید گلبول های سفید، قرمز و پلاکت جدید و سالم می باشند.در سال ۱۹۹۸، دانشمندان به پیشرفت بزرگی در زمینۀ جدا ساختن سلول های بنیادی جنین و کشف آنها در محیط آزمایشگاهی نایل شدند. محققان همچنین نحوه متوقف ساختن این سلول ها از تمایز یافتن و نحوۀ نگهداری آنها در یک وضعیت تمایزیابی با قدرت حداکثر را کشف کرده اند. با فراهم شدن این مقدمات، اکنون محققان در جستجوی راهی برای هدایت این سلول ها برای ساخت سلول های مغزی جدید با کلیوی جدید هستند. همچنین چین سلول هایی احتمالاً می توان در درمان بیماری هایی مثل پارکینسون، آلزایمر (جنون پیری) یا نارسایی کلیه که در حال حاضر درمان مؤثری برای آنها وجود ندارد، استفاده کرد.
 شکل ۶-۱۸٫ هنگامی که یک سلول بنیادی تقسیم می شود. سلل بنیادی تمایز یافته تری ایجاد- سلولی که می تواند سلول هایی با عملکرد اختصاصی، مانند سلول های خونی ایجاد کند. سلول بنیادی به علاوه نسخه دقیقی از خودش (رونوشت) هم می سازد.
شکل ۶-۱۸٫ هنگامی که یک سلول بنیادی تقسیم می شود. سلل بنیادی تمایز یافته تری ایجاد- سلولی که می تواند سلول هایی با عملکرد اختصاصی، مانند سلول های خونی ایجاد کند. سلول بنیادی به علاوه نسخه دقیقی از خودش (رونوشت) هم می سازد.از دیگر کشفیات مهم در سال های اخیر، پی بردن به وجود سلول های بنیادی بالغ در شماری از بافت ها بود که در گذشته تصور می شد حاوی چنین سلول هایی نیستند. مانند مغز، عضلات اسکلتی، کبد، لوزالمعده و قرنیه چشم. اگر امکان جداسازی دقیق و صحیح این سلول ها و رشد آنها در محیط کشت فراهم شود. می توان از آنها در ساخت بافت سالم در صورت نیاز استفاده کرد. به علاوه، برخی از شواهد حکایت از آن دارد که حتی می توان سلول های بنیادی بالغ را در جهت ساخت بافت های دیگری، غیر از بافت مادر، تحریک کرد.از کشت سلول های بنیادی می توان در آزمایش تأثیر برخی از داروها بر انواع مختلف سلول ها نیز استفاده کرد. چنانچه آزمون سلولی، بی خطر و مفید بودن داروها را اثبات کند، می توان آنها را بر روی حیوانات و انسان ها امتحان کرد.
موانع
در عرصۀ تحقیقات بر روی سلول های بنیادی، همچنان باید منتظر رویارویی با چالش های عمده ای باشیم. دانشمندان باید درک و اطلاع بهتری از نحوه تمایز یافتن سلول های بنیادی به منظور تحریک آنها در تشکیل بافت های مختلف، پیدا کنند. همچنین این نگرانی وجود دارد که سلول های پیوند شده ممکن است پذیرفته نشوند، زیرا سلول های مشتق از بافت رویان یا جنین از لحاظ ژنتیکی با سلول های شخص دریافت کننده آنها متفاوت خواهند بود.یکی از راه های اجتناب از رد پیوند، متضمن به دست آوردن سلولی به همراه هسته اش از گیرنده احتمالی پیوند (البته به غیر از سلول تخمک یا اسپرم) و امتزاج آن با یک سلول تخمک از فرد دهنده که هستۀ آن را در آورده اند (انتقال هسته ای سلول بدنی یا اصطلاحاً سلول سوماتیک) می باشد. بدین ترتیب، سلول امتزاج یافته، حاوی دی- ان- ای خود گیرنده خواهد بود و بنابراین سیستم ایمنی فرد را به فرد پیوند تحریک نخواهد کرد. این فرآیند انتقال دی- ان- ای را اصطلاحاً شبیه سازی درمانی می نامند.راه دیگر پیشگیری از رد پیوند، استفاده از سلول های بنیادی خود فرد برای پیوند است. مشکلی که در این روش وجود دارد آن است که سلول های بنیادی بالغ به میزان ناچیزی در بدن وجود دارند، و از این رو جدا ساختن و برداشت آنها کار دشواری خواهد بود. به علاوه، امکان تکثیر و زنده ماندن آنها در محیط آزمایشگاهی به خوبی سلول های بنیادی رویان (جنین در هفته های اول) نمی باشد. ضمن اینکه ممکن است این سلول ها حاوی جهش هایی در دی- ان- ای باشند که در طول حیات فرد رخ داده اند.تحقیقات بر روی سلو بنیادی همچنان ادامه دارد و تا به کارگیری آن، به شکل جدّی در امر درمان، راه زیادی را باید بپیماییم. امّا در صورت پیشرفت در زمینه پیوند مغز استخوان و خون، سرانجام روزی فرا خواهد رسید که سلول های بنیادی جان بسیاری را نجات خواهند داد.جایگزین کردن یا تکمیل ژن های معیوب با ژن های سالم می تواند احتمالاً پیشرفت بیماری را متوقف یا معکوس سازد. این شیوه برای برخی از سرطان ها که حاصل ناتوانی یک ژن خاص در سرکوب رشد غیرطبیعی سلول ها هستند نیز مورد استفاده قرار می گیرد. تزریق ژن های سالم به داخل سلول ها می تواند برای مکمل سازی برخی از نقایص یا کمبودهای پروتئینی، مثلاً در برخی از انواع کم خونی ها نیز مؤثر واقع شود.
نابودسازی سلول های مضر
کشتن سلول های مضر مستلزم فرو کردن ژنی به داخل این سلول هاست، به گونه ای که باعث ساخت پروتئینی شوند که منجر به خودکشی سلول (آپوپتوز) شده یا آنها را نسبت به داروهایی که برای نابودی آها تجویز می شوند آسیب پذیر سازند. مطالعات حکایت از امکان استفاده از این روش در کنار داروهای متداول و در دسترس و پرتودرمانی به منظور نابودی مؤثرتر و سلول های مضر دارد. این نوع می تواند درمان غده های سرطانی (بدخیم) مفید واقع شود.
روش ها
یک چالش اساسی بر سر راه ژن درمانی به ارائه مؤثر، صحیح و بی خطر ژن های سالم به سلول های انتخاب شده برای تغییر ژنی یا تخریب، مربوط می شود. محققان در حال حاضر بر روی روش های زیر کار می کنند:
پیوند سلول بنیادی
سلول های بنیادی، سلول هایی تمایز نیافته اند که توانایی تقسیم و تبدیل به سلول های تمایز یافته تر را دارند. فعلاً، بزرگترین استفاده از سلول های بنیادی در پیوند مغز استخوان به منظور درمان افراد مبتلا به بیماری هایی مثل لوسمی، لنفوم، کم خونی آپلاستیک و برخی از اختلالات ارثی در سیستم ایمنی، می باشد. مغز استخوان حاوی سلول های بنیادی خون است که گلبول های سفید، قرمز و پلاکت تولید می کنند.یکی از روش های وارد کردن نسخه های جدید ژن ها به داخل سلول های بدن از طریق پیوند سلول های بنیادی در مغز استخوان است. این عمل به دو صورت انجام می شئد. یکی مستلزم استفاده از شیمی درمانی به منظور تخریب مغز استخوان ناسالم در فرد مبتلا و سپس پیوند سلول های بنیادی سالم از یک دهندۀ سازگار، مثلاً برادر یا خواهر به داخل مغز استخوان تخریب شده برای تولید سلول های خونی جدید و سالم می باشد.به گلبول های سفید اغلب توجه زیادی می شود، زیرا قادر به تولید آنزیم هایی هستند که ممکن است فرد بیمار با کمبود آنها مواجه باشد. مثلاً، کارآزمایی های بالینی اولیه در کودکان مبتلا به بیماری ماروتو- لامی نشان داد که وقتی گلبل های سفید نوساز، حتی به میزان ناچیز ۱۰ درصد از مقادیر طبیعی، آنزیم موردنیاز فرد را تولید کردند، حال عمومی بچه بهبود پیدا کرد. امّا، متأسفانه پیوند سلول بنیادی بسیار گران است. این عمل خطرناکی را هم به دنبال دارد، مثل عفونت و مرگ و گاهی اوقات تنها برای یک مدت کوتاه مؤثر است.دومین راه درمان افراد مبتلا به اختلال آنزیمی عبارت است از: جدا ساختن گلبول های سفید نابالغ (سلول های بنیادی) از مغز استخوان و فرو کردن ژن های مناسب که به روش مهندسی ژنتیک تهیه شده اند، به داخل آنها قبل از بازگرداندن سلول ها به فرد. این روش خطر کمتری نیز به همراه دارد، زیرا نیازی به نابودسازی مغز استخوان خود فرد با تشعشع و شیمی درمانی نیست. سلول های جدید در مغز استخوان قادر به همزیستی با سلول های قدیمی هستند. مادامی که سلول های جدید حتی به میزان نسبتاً اندکی آنزیم طبیعی می سازند، اهمیتی ندارد که سلول های قدیمی آنزیم معیوب یا غیر طبیعی تولید کنند. یکی از چالش های مربوط به این روش درمانی وارد کردن ژن جایگزین به داخل هسته سلول است، یعنی جایی که باید فعالیت خود را در آنجا آغاز کند.
ناقل های ویروسی
شکل دیگری از ژن درمانی با استفاده از ویروس هایی به عنوان ناقل (وکتور) دی- ان- ای سالم انجام گیرد. ویروسی که به طور رایج در آزمایشات ژن درمانی مورد استفاده قرار می گیرد، آدنوویروس است. که باعث سرماخوردگی می شود. سایر ویروس های مورد استفاده عبارتند از: رترو ویروس ها، ویروس های آبله، و ویروس هرپس (تبخال)- ناقل- درمانی ویروسی بر آنچه ویروس ها به شکل طبیعی انجام می دهند، مزیت دارد- زیرا در اینجا ویروس ها در سرتاسر بدن انتشار یافته و ژن های خود را وارد سوللهای انسانی می کنند.برای انجام این عمل، یک نمونۀ سلولی، معمولاً سلول های بنیادی مغز استخوان، از شخصی که قرار است ژن درمانی شود، گرفته می شود. این سلول ها را سپس در محیط آزمایشگاهی کشت می دهند. پزشکان ژن های بیماری زا را از ویروس ناقل جدا و ژن های درمان گرا را به داخل ذرات ویروس وارد می کنند. سپس به ویروس اجازه داده می شود تا سلول های بنیادی مغز استخوان را مورد تهاجم قرار دهد. امید آن می رود که ویروس، ژن های اصلاح گر مناسب را به دی- ان- ای سلول الحاق کند. این سلول های عفونی شده را در مرحله بعد به صورت یک تزریق وریدی به فرد باز می گردانند. با ورود به بدن، این سلول ها به مغز استخوان مهاجرت کرده ودر آنجا شروع به تولید پروتئین اصلاحی می کنند.متأسفانه، ژن های ویروسی درمانگر، همیشه در محیط آزمایشگاهی به اندازه کافی سلول های مغز استخوان را درگیر می کنند تا موقع پیوند به فرد، مؤثر واقع شوند. اکثر بیماریها زمانی رخ می دهند که میزان آنزیم یا پروتئین تولیدی توسط یک ژن خاص به کمتر از ۱ الی ۱۰ درصد مقادیر طبیعی برسد. درمان یک اختلال مستلزم آن است که فرد دست کم این مقدار از آنزیم طبیعی را تولید کند. امّا حتی دست یابی به همین مقدار اندک هم تاکنون کاری دشوار بوده است.مشکل دیگری که در رابطه با ژن درمانی ویروسی وجود دارد، این است که ممکن است ژن جایگزین در مرحله انتقال گم و گور شده و به دی- ان- ای سلول نچسبید. حتی در صورتی که سلول های مغز استخوان به میزان کافی با ویروس آلوده شوند، چنانچه دی- ان- ای در خلال تقسیم سلولی بعدی به طریقی از بین برود، تمام زحمت ها بر باد خواهد رفت.به علاوه، امکان دارد خود ویروس هتگان تزریق شدن به بدن فرد تکثیر یافته و مشکلاتی را به بار آورد. ناقل های ویروسی ممکن است در هنگام تزریق باعث نوعی پاسخ ایمنی یا عفونت هم بشوند. در صورت بروز پاسخ ایمنی علیه ویروس در فرد، این ویروس دیگر قادر نخواهد بود برای الحاق دی- ان- ای ترمیمی وارد سلول میزبان شود. در چنین حالتی، ناقل، به تدریج تأثیر و توانایی خود را در مسیر تولید پروتئین طبیعی از دست می دهد.
ناقل های غیرویروسی
محققان راه های دیگری را هم برای وارد کردن دی- ان- ای ترمیمی به داخل سلول های فرد مبتلا به یک بیماری ژنتیکی خاص مورد آزمایش قرار داده اند. یکی از این روش ها، استفاده از گویچه های ریز چربی به عنوان ناقل (وکتور) ژن ترمیمی یا اصلاح گر است. با اتصال گویچۀ چربی به چربی موجود در غشاء سلول، دی- ان ای داخل این گویچه ها به درون سلول آزاد می شود.اساس این روش بر توانایی دی- ان- ای ترمیمی در اتصال به دی- ان- ای خود فرد در هستۀ سلول، استوار است. این یعنی دی- ان- ای ترمیمی نه تنها باید وارد سلول شود بلکه بعد از آن باید خود را به هسته سلول هم برساند. این عمل در سلول هایی که توانایی تقسیم دارند بیشترین تأثیر را دارد. بنابراین، گلبول های سفید گزینۀ خوبی برای این عمل هستند، زیرا قابلیت تقسیم دارند. طبیعتاً اکثر سلول های مغزی که تقسیم نمی شوند نامزد مناسبی برای این عمل نخواهند بود. محققان همچنان در حال کار کردن بر روی راه هایی هستند تا بتوان امکان اتصال کارآمد دی- ان- ای ترمیمی به دی- ان- ای فرد را افزایش داد.
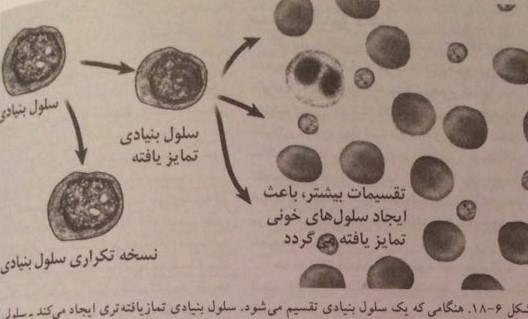 شکل ۶-۱۸٫ هنگامی که یک سلول بنیادی تقسیم می شود. سلل بنیادی تمایز یافته تری ایجاد- سلولی که می تواند سلول هایی با عملکرد اختصاصی، مانند سلول های خونی ایجاد کند. سلول بنیادی به علاوه نسخه دقیقی از خودش (رونوشت) هم می سازد.از دیگر کشفیات مهم در سال های اخیر، پی بردن به وجود سلول های بنیادی بالغ در شماری از بافت ها بود که در گذشته تصور می شد حاوی چنین سلول هایی نیستند. مانند مغز، عضلات اسکلتی، کبد، لوزالمعده و قرنیه چشم. اگر امکان جداسازی دقیق و صحیح این سلول ها و رشد آنها در محیط کشت فراهم شود. می توان از آنها در ساخت بافت سالم در صورت نیاز استفاده کرد. به علاوه، برخی از شواهد حکایت از آن دارد که حتی می توان سلول های بنیادی بالغ را در جهت ساخت بافت های دیگری، غیر از بافت مادر، تحریک کرد.از کشت سلول های بنیادی می توان در آزمایش تأثیر برخی از داروها بر انواع مختلف سلول ها نیز استفاده کرد. چنانچه آزمون سلولی، بی خطر و مفید بودن داروها را اثبات کند، می توان آنها را بر روی حیوانات و انسان ها امتحان کرد.
شکل ۶-۱۸٫ هنگامی که یک سلول بنیادی تقسیم می شود. سلل بنیادی تمایز یافته تری ایجاد- سلولی که می تواند سلول هایی با عملکرد اختصاصی، مانند سلول های خونی ایجاد کند. سلول بنیادی به علاوه نسخه دقیقی از خودش (رونوشت) هم می سازد.از دیگر کشفیات مهم در سال های اخیر، پی بردن به وجود سلول های بنیادی بالغ در شماری از بافت ها بود که در گذشته تصور می شد حاوی چنین سلول هایی نیستند. مانند مغز، عضلات اسکلتی، کبد، لوزالمعده و قرنیه چشم. اگر امکان جداسازی دقیق و صحیح این سلول ها و رشد آنها در محیط کشت فراهم شود. می توان از آنها در ساخت بافت سالم در صورت نیاز استفاده کرد. به علاوه، برخی از شواهد حکایت از آن دارد که حتی می توان سلول های بنیادی بالغ را در جهت ساخت بافت های دیگری، غیر از بافت مادر، تحریک کرد.از کشت سلول های بنیادی می توان در آزمایش تأثیر برخی از داروها بر انواع مختلف سلول ها نیز استفاده کرد. چنانچه آزمون سلولی، بی خطر و مفید بودن داروها را اثبات کند، می توان آنها را بر روی حیوانات و انسان ها امتحان کرد.